Gases são fluidos no estado gasoso, a
característica que o difere dos fluidos líquidos é que, quando colocado em um
recipiente, tem a capacidade de ocupa-lo totalmente. A maior parte dos
elementos químicos não metálicos conhecidos é encontrado no seu estado gasoso,
em temperatura ambiente.
Diferença entre Gás e Vapor
A diferença entre gás e vapor é dada a partir da temperatura. O vapor é a matéria no estado gasoso, estado esse que pode ser liquefeito com o aumento da pressão. Com o gás não ocorre o mesmo. Ele é um fluido impossível de ser liquefeito com um simples aumento de pressão. Isso faz com o gás seja diferente do vapor.
Pressão do Gás
É quando as moléculas do gás, ao se movimentarem,
colidem com as outras moléculas e com as paredes do recipiente onde se
encontram, exercendo uma pressão. A pressão tem relação com o volume do gás e à
temperatura absoluta.
Ao ter a temperatura aumentada, as moléculas do gás
aumentam sua agitação, provocando mais colisões. Quando aumenta o volume do
recipiente, as moléculas tem mais espaço para se deslocar, com isso, as
colisões diminuem, diminuindo a pressão.
Gás perfeito ou Gás ideal
Os gases reais que
normalmente apresentam características moleculares diferentes e particulares de
cada um. Contudo, se colocarmos todos eles a altas temperaturas e baixas
pressões eles passam a apresentar comportamentos muito semelhantes. No estudo
dos gases adota-se um modelo teórico, simples e que na prática não existe, com
comportamento aproximado ao dos gases reais. Essa aproximação é cada vez melhor
quanto menor for a pressão e maior a temperatura.
Características de um Gás perfeito
O movimento das moléculas é regido pelos princípios da mecânica Newtoniana;
Os choques entre as moléculas são perfeitamente elásticos, ou seja, a quantidade de movimento é conservada;
Não há atração e nem repulsão entre as moléculas;
O volume de cada molécula é desprezível quando comparado com o volume total do gás.
Referencias
http://www.brasilescola.com/fisica/estudo-dos-gases.htm
http://www.infoescola.com/fisico-quimica/gases/
http://www.sofisica.com.br/conteudos/Termologia/EstudodosGases/gases.php
Postado por: Luiz Gonzaga; Luiz Gustavo; Mateus Costa; Rodrigo Jorge.
Transformações Gasosas
Como explicado acima, os gases possui moléculas bastante agitadas, para dar um exemplo superficial, e como se você entrasse em uma creche na hora do recreio, a agitação da criançada se compara a agitação molecular o gás, o gás e influenciado por tres grandezas, volumetrica ou volume geralmente calculada em litros, pressao geralmente calculada em "atm" (pressão atmosferica) e temperaturam sempre calculada em
"K" kelvin, existem 4 tipos de transformaçoes que seram explicadas abaixo. 
Transformação Isovolumétrica ou Isocórica
Em uma transformação isocórica, o volume do gás permanece constante tendo apenas variação da temperatura da pressão, a
pressão exercida no recipiente que o gás se encontra aumenta de acordo com o aumento da temperatura e diminui de acordo com a temperatura...
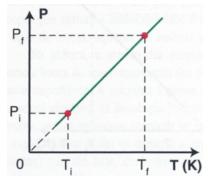
Um exemplo disso no nosso dia a dia e a calibragem dos pneus dos veículos, ele deve ser sempre ser feito a frio pois a pressão interna pode aumentar ser o gás for quente e o pneu explodir...

Tme
Charles conseguiu observar esse fenômeno e propôs a seguinte formula:
Pi/Pf
-----
Ti/Tf
Graças a ele podemos descobrir a pressão e temperatura inicial e final, sem a necessidade de saber o volume já que e constante...
Pi: Pressão inicial
Ti: Temperatura inicial
Pf: Pressão final
Tf: Temperatura final
Exemplo:
1) (FUVEST – SP) Um recipiente indeformável, hermeticamente fechado, contém 10 litros de um gás perfeito a 30 ºC, suportando a pressão de 2 atmots. A temperatura do gás é aumentada até atingir 60º C.
a) Calcule a pressão final do gás.
b) Esboce o gráfico pressão versus temperatura da transformação descrita.
Solução:
Letra a)Considerando-se que o volume do gás é constante, temos que a transformação é isocórica.
Assim,

Substituindo os valores fornecidos pelo problema na equação da transformação isocórica, temos:

Assim, podemos concluir que a pressão e a temperatura são grandezas diretamente proporcionais.
< Edição Marcus Alexandre "Jimmy", William Ribeiro, Roberto Petry, Carliane Sandes, Fernanda Thalia, Bruna, Thalita Emille, Paulo Jesse, Deivison da Silva, Miller Moreira>
<Referecial: Imagem
http://www.alunosonline.com.br/quimica/transformacao-isocorica.html
http://www.infoescola.com/termodinamica/transformacao-isovolumetrica-isocorica/
http://www.brasilescola.com/quimica/transformacoes-gasosas.htm
http://www.brasilescola.com/fisica/transformacoes-gasosas-exercicios-resolvidos.htm >

Transformação Isovolumétrica ou Isocórica
Em uma transformação isocórica, o volume do gás permanece constante tendo apenas variação da temperatura da pressão, a
pressão exercida no recipiente que o gás se encontra aumenta de acordo com o aumento da temperatura e diminui de acordo com a temperatura...

Um exemplo disso no nosso dia a dia e a calibragem dos pneus dos veículos, ele deve ser sempre ser feito a frio pois a pressão interna pode aumentar ser o gás for quente e o pneu explodir...

Tme

Charles conseguiu observar esse fenômeno e propôs a seguinte formula:
Pi/Pf
-----
Ti/Tf
Graças a ele podemos descobrir a pressão e temperatura inicial e final, sem a necessidade de saber o volume já que e constante...
Pi: Pressão inicial
Ti: Temperatura inicial
Pf: Pressão final
Tf: Temperatura final
Exemplo:
1) (FUVEST – SP) Um recipiente indeformável, hermeticamente fechado, contém 10 litros de um gás perfeito a 30 ºC, suportando a pressão de 2 atmots. A temperatura do gás é aumentada até atingir 60º C.
a) Calcule a pressão final do gás.
b) Esboce o gráfico pressão versus temperatura da transformação descrita.
Solução:
Letra a)Considerando-se que o volume do gás é constante, temos que a transformação é isocórica.
Assim,

Substituindo os valores fornecidos pelo problema na equação da transformação isocórica, temos:

Assim, podemos concluir que a pressão e a temperatura são grandezas diretamente proporcionais.
< Edição Marcus Alexandre "Jimmy", William Ribeiro, Roberto Petry, Carliane Sandes, Fernanda Thalia, Bruna, Thalita Emille, Paulo Jesse, Deivison da Silva, Miller Moreira>
<Referecial: Imagem
http://www.alunosonline.com.br/quimica/transformacao-isocorica.html
http://www.infoescola.com/termodinamica/transformacao-isovolumetrica-isocorica/
http://www.brasilescola.com/quimica/transformacoes-gasosas.htm
http://www.brasilescola.com/fisica/transformacoes-gasosas-exercicios-resolvidos.htm >
----
A lei dos
gases ideias
A lei dos gases ideais é a
equação de estado do gás ideal, um gás hipotético
formado por partículas pontuais, sem atracção nem repulsão entre elas e cujos
choques são perfeitamente elásticos (conservação do momento e da energia
cinética). Os gases reais que mais se aproximam ao comportamento do gás ideal
são os gases monoatómicos em condições de baixa pressão e alta temperatura.
Empiricamente, observam-se uma série de relações
entre a temperatura, a pressão e o volume que dão lugar à lei dos gases
ideais, deduzida pela primeira vez por Émile Clapeyron, em 1834.
A equação de
estado
A equação que descreve normalmente a relação entre
a pressão, e volume, a temperatura e a quantidade (em moles)
de um gás ideal é:
onde:
= Pressão
= Volume
= Mols de gás.
= Constante universal dos gases perfeitos
= Temperatura em Kelvin.
A equação de
estado
Tomando
em conta as forças intermoleculares e volumes intermoleculares finitos,
obtém-se a equação para gases reais, também chamada equação de Van der Waals:
Onde:
= Pressão do gás ideal
= Volume do gás ideal
= Mols de gás
= Constante universal dos gases perfeitos
= Temperatura
e
são constantes determinadas pela natureza do gás com o fim de que haja a maior congruência possível entre a equação dos gases reais e o comportamento observado experimentalmente.
Valores de R em diferentes unidades
Valores de R
|
Teoria cinética molecular
Desenvolvida
por Ludwig Boltzmann e Maxwell. Indica-nos
as propriedades de um gás ideal a nível molecular.
- Todo o gás ideal é formado por pequenas partículas esféricas chamadas moléculas.
- As moléculas gasosas movem-se a altas velocidades, em forma recta e desordenada.
- Um gás ideal exerce uma pressão continua sobre as paredes do recipiente que o contém, devido aos choques das moléculas com as paredes deste.
- Os choques moleculares são perfeitamente elásticos. Não há perda de energia cinética.
- Não se tem em conta as interacções de atracção e repulsão molecular.
- A energia cinética média da translação de uma molécula é diretamente proporcional à temperatura absoluta do gás.
Equação geral dos gases ideais
Para uma mesma massa gasosa (portanto, o número de
moles (n) é constante; n=cte), podemos afirmar que existe uma constante diretamente proporcional à pressão e volume do gás, e
inversamente proporcional à sua temperatura.
Processos gasosos particulares
Processos
realizados mantendo constante um par de suas quatro variáveis (n, p, V, T), de
forma que fiquem duas; uma livre e outra dependente.
Deste
modo, a fórmula acima exposta para os estados 1 e 2, pode ser operada
simplificando 2 ou mais parâmetros constantes. Segundo cada caso, recebem os
nomes:
Lei de Boyle-Mariotte
Também
chamado processo isotérmico. Afirma que, a temperatura e quantidade de matéria
constante, o volume de um gás é inversamente proporcional à sua pressão:
(n, T
ctes.)
Leis de Charles e Gay-Lussac
Em 1802,
Louis Gay Lussac publica os resultados de suas experiências, baseadas nas que
Jacques Charles fez em 1787. Considera-se assim so processo isócoro para a Lei
de Charles, e ao isobárico (ou isostérico) para a lei de Gay Lussac.
Processo isobárico (de Gay Lussac)
(n, P
ctes.)
|
Processo isocórico (isovolumétrico) de Charles
(n, V
ctes.)
|
Lei de Avogadro
Amedeo
Avogadro em 1811 e complementava as de Boyle, Charles e Gay-Lussac. Assegura
que num processo a pressão e temperatura constante (isobárico e isotérmico), o
volume de qualquer gás é proporcional ao número de moles presente, de tal modo
que:
(T, P
ctes.)
Esta
equação é válida incluindo para gases ideais distintos. Uma forma alternativa
de enunciar esta lei é:
O volume
que ocupa uma mol de qualquer gás ideal a uma temperatura e pressão
dadas é sempre a mesma.
Um mol
de qualquer gás ideal a uma temperatura de 0 °C (=273,15 K) e uma pressão
de 1013,25 hPa ocupa um volume de exatamente 22,4 litros.
Postado por: Natália Sousa, Laryssa Silva, Luciana Cristina, Nattalia Vieira e Marcos Vitor.
Lei
de Boyle ou
Transformação
Isotérmica
Um gás sofre uma transformação isotérmica quando há a variação da sua
pressão e do seu volume, com a temperatura sendo mantida constante. Nesse caso,
surgiu a Lei de Boyle, que diz que a pressão e o volume de um gás são
inversamente proporcionais.Eles observaram uma
relação entre pressão e volume que foi quantificada e notaram que essa relação
se repetia para todos os gases. Por isso, criou-se a Lei de Boyle,
também conhecida como Lei de
Boyle-Mariotte que
diz o seguinte:
“Em um sistema
fechado em que a temperatura é mantida constante, verifica-se que determinada
massa de gás ocupa um volume inversamente proporcional a sua pressão.”
Postado por: Samantha Lira, Sara Barroso, Thais
Santiago e Thamirys Soares
Lei de Boyle
Robert Boyle foi responsável pela lei
que rege as transformações sofridas por determinada massa de nosso modelo de
gás perfeito quando sua temperatura se mantém constante (transformação isotérmica).
É de fácil compreensão que uma redução de volume de um o gás aumentara a concentração
de partículas, aumentando o numero de colisões nas paredes do recipiente,
provocando um aumento na pressão do gás. Em contrapartida, o aumento do volume
irá ”espalhar” mais as partículas, diminuindo a concentração de choques nas
paredes do recipiente, diminuindo assim a pressão do gás.
Para o modelo de gás perfeito vale o enunciado
a seguir.
Quando determinada massa de um gás perfeito
sofre uma transformação isotérmica,
sua pressão é inversamente proporcional ao volume por ele ocupado.
Exemplo1: (UNIMEP – SP) 15 litros de uma determinada massa gasosa encontram-se a uma pressão de 8,0 atm e à temperatura de 30º C. Ao sofrer uma expansão isotérmica, seu volume passa a 20 litros. Qual será a nova pressão do gás?
Do enunciado temos:
V1 = 15 litros
V2 = 20 litros
P1 = 8,0 atm
P2 = ?
T = 30º C = 303 K (TEMPERATURA CONSTANTE)
Utilizando a equação da transformação
isotérmica, temos:
Exemplo 2: Certo gás contido em um recipiente de
1m³ com êmbolo exerce uma pressão de 250Pa. Ao ser comprimido isotérmicamente a
um volume de 0,6m³ qual será a pressão exercida pelo gás?
Exemplo 3:
O gráfico acima mostra a isoterma de
uma quantidade de gás que é levado de um estado 1 para um estado 2. O volume do
estado 2, em litros, é:
(a) 2 L
(b) 4,5 L
(c) 6 L
(d) 4 L
(e) 3 L
No
estado 1, temos:
P1
= 10 atm
V1
= 2,0 L
No
estado 2:
P2
= 5 atm
V2
= ?
Como
temos o gráfico de uma isoterma, indica que o gás foi do estado 1 para o dois
sem que houvesse uma variação de temperatura, assim sendo, trata-se de uma
transformação isotérmica. Para resolvermos a questão, vamos aplicar a lei da
transformação isotérmica, também conhecida como Lei de Boyle – Mariotte:
Letra (d)
Exemplo 4: - Um gás ideal ocupa 6 litros em um recipiente, a pressão dentro do frasco é de 3 atm. Suponha que o gás sofra uma expansão isotérmica e passe a ocupar 9 litros. Qual será a pressão dentro do frasco?
Equação para gás ideal:
Fontes: Newton; Helou; Guauter- Física do 2ºano-editora
saraiva
http://www.brasilescola.com/upload/e/for9.jpg
EXPANSÃO
E COMPRESSÃO DE UM GÁS
O que
acontece?
Quando um
determinado gás estiver contido em um recipiente fechando e uma de suas paredes
for móvel, no caso, um embolo, é possível que este se desloque. Nesse caso,
haverá trabalho e, conseqüentemente, a transferência de energia, fazendo com
que o gás receba ou ceda energia. O que envolve duas situações: a sua expansão
ou compressão.
Expansão
Imaginando
que as colisões entre as partículas do gás e o embolo sejam intensas o bastante
para que a parede móvel se desloque, aumentando o volume interno. Afirmamos
então, que o gás realizou trabalho, e também cedeu energia para empurrar a
parede.
Como no
caso citado, não ocorreu nenhuma outra troca de energia com o ambiente, a
energia interna diminui, fazendo com que ele se resfrie. Nessas situações o
trabalho possui sinal positivo. Já que o embolo desloca no mesmo sentido da
resultante das forças aplicadas pelas partículas.
Compressão
Agora
imaginando que um agente qualquer, externo, empurre o embolo, diminuindo seu
volume. Nesse caso, afirmamos que o gás recebeu trabalho e energia, pois a
parede o empurrou. Como no caso anterior, também não houve trocas com o meio
externo, sendo assim, a energia interna aumenta e ele aquece.
Nesses
casos o trabalho possui sinal negativo. Já que o embolo desloca no sentido
contrario ao da resultante das forças aplicadas pelas partículas.
Experimento
com expansão e compressão de um gás
Postado por: Danielle Feitoza e Enolla Diniz.
Densidade Absoluta dos Gases
A densidade absoluta ou massa específica de um gás é a relação entre a massa e o volume do gás, nas condições de pressão e temperatura consideradas.
Densidade de um gás
Densidade de um gás nas CNTP:
dCNTP = M
——
22,4 g/L
Densidade de um gás a uma pressão p e temperatura T:
d = p•M
——
R•T
Densidade de um gás A em relação a um gás B:
dA,B = MA
——
MB
Densidade de um gás A em relação ao ar:
dA,ar = MA
——
Mar = MA
——
28,8
A densidade é uma grandeza que pode ser calculada através da relação entre a massa e o volume do corpo. Isso também se aplica ao caso dos gases:
dgás = mgás
Vgás
A unidade de densidade dos gases costuma ser g/L.
Sabe-se que nas CNTP (Condições Normais de Temperatura e Pressão) 1 mol de qualquer gás sempre ocupa um volume de 22,4 L. Assim, a densidade para gases nessas condições podem ser calculadas pela relação entre a massa molar e esse volume em mols:
dgás = ___M_____
22,4 L . mol-1
Mas essa fórmula só pode ser usada se o gás estiver nas CNTP. Se quisermos calcular a densidade absoluta para qualquer gás, podemos usar outra fórmula que encontramos por meio da equação de estado dos gases:
pV = nRT
Sendo que n = m/M, substituímos “n” na equação de estado dos gases:
pV = mRT
M
m = pM
V RT
Como a densidade é a massa sobre o volume, então temos:
d = pM
RT
Essa equação nos mostra que a densidade absoluta de um gás depende da pressão e da temperatura em que o gás se encontra; isso ocorre não é por causa da massa, pois ela não depende da pressão e da temperatura, mas o volume depende.
Observe que a densidade do gás é inversamente proporcional à sua temperatura. Esse é o princípio que explica como funciona a prática do balonismo: o ar do balão é o ar atmosférico que, quando aquecido, diminui de densidade e, dessa forma, eleva-se ao céu. Quanto mais se aquecer o ar contido no balão, menor será sua densidade e mais o balão subirá.
Veja um exemplo de como utilizar essa fórmula para descobrir a densidade de um gás:
Exemplo: Qual a densidade absoluta do gás oxigênio (O2) a 600 mmHg e 127 ºC? (Massa atômica: O = 16)
Resolução:
Dados:
Massa molar: O2: 2 . 16 = 32 g/mol;
p = 600 mmHg;
R = 62,3 mmHg . L . mol-1 . K-1
T = 127 ºC → 127 + 273 = 400 K
d = PM
RT
d = _600 . 32__
62,3 . 400
d = 0,774 g/L
Visto que nas CNTP a pressão é igual a 1 atm, a temperatura é 273 K e R é igual a 0,082 ou 22,4/273, temos:
d = PM
RT
d = ___1 . M_____
(22,4/273) . 273
d = ___M_____
22,4 L . mol-1
Chegamos novamente à fórmula mencionada anteriormente para os gases nas CNTP. Vejamos um exemplo de como usar essa fórmula:
Exemplo: Qual é a massa molecular de um gás cuja densidade absoluta nas CNTP é de 1,96 g/L?
Resolução:
d = ___M_____
22,4 L . mol-1
M = 22,4 . d
M = (22,4 L/mol) . (1,96 g/L)
M = 43,90 g/mol

Linkhttp://www.google.com.br/imgres?biw=1280&bih=922&tbm=isch&tbnid=3V6qCi9Ed6ouuM:&imgrefurl=http://maisum.altervista.org/tag/tirinhas-engracadas/page/5/&docid=5FCGM56SSyK20M&imgurl=http://maisum.altervista.org/wp-content/uploads/2012/02/z-tirinha-gases.jpg&w=640&h=299&ei=PbSbUtWkIOe_sQSTuYGACw&zoom=1&ved=1t:3588,r:0,s:0,i:77&iact=rc&page=1&tbnh=153&tbnw=329&start=0&ndsp=23&tx=167&ty=84
http://www.brasilescola.com/quimica/densidade-absoluta-dos-gases.htm
http://www.fisica.net/quimica/resumo17.htm
Integrantes : fabricielle arcanjo , tyele dias , jhennyfer lima, reinaldo silva, rayra jhennyfer










Estudo dos gases é um tema da física muito interessante, no entanto falta algumas leis geral dos gases, a formula dos gases perfeitos e exemplos dos gases reais. Por fim, o trabalho em si esta bom.
ResponderExcluirMuito Interessante os Trabalhos, tive uma compreenssão maior dos assuntos '' Valores de R em diferentes Unidades'' e as ''Leis dos estudos dos Gases''. Parabéns Pelos Trabalhos.
ResponderExcluirIsso serve para entedermos melhor o assunto, tive mais facilidade para compreende-los!
ResponderExcluirParabens!
Gosteii!
ResponderExcluirParabens!
Está criativo,interessante,e o conteúdo está com uma facilidade de compreender.
THAMIRYS SOARES-201
Parabéns, achei bem elaborado...
ResponderExcluirqual a maior dificuldade que vcs obtiveram na realização do trabalho?
ResponderExcluirOrganização de divisão de conteúdo, foi péssima, estava cada um por si, não respeitaram escolhas de conteúdos e resultou nessa desorganização didática.
Excluiré como o marcus falou..e também muitos entrarem ao mesmo tempo acabou causando congestionamento..
ExcluirMas em relação ao conteúdo...os livros vem com ótima dinâmica e a internet também há conteúdo bem amplos e de facil aprendizagem.
parabéns, esta bem desenvolvido e facilmente dar para ser compreendido.
ResponderExcluirSim, tem uma desorganização dos trabalhos, mas tirando isso da pra compreender o conteúdo que foi abordado pelos grupos!
ResponderExcluirThais Santiago 201
Todo o conteúdo foi muito importante para o nosso desenvolvimento e conhecimento nessa área...
ResponderExcluirEsse conteúdo nos trouxe varias descobertas e novidades..muito bom
Nattalia Vieira
Entao os trabalhos bons, faltam algumas coisas como organizacao e dominio de assunto. Mas fora isso ests bom.
ResponderExcluirExcelente Trabalho, isso mostra a dedicação dos alunos em fazer um ótimo trabalho em grupo.... Gostei muito me ajudou bastante....
ResponderExcluirUm ótimo trabalho... E isso mostra que os alunos estão empenhados com esse assunto... Que vivenciamos no nosso dia-a-dia.
ResponderExcluirEsse trabalho está muito bom, pois o conteúdo que ele coloca em questão é de extrema importância, e apesar da desorganização, no meu ponto de vista não influenciaram no seu objetivo que foi fornecer aos visitantes um melhor entendimento sobre o assunto...
ResponderExcluirLegal!
Trabalho esta muito interessante, bem compreensível, a pagina esta visualmente agradável, parabéns a todos que se empenharam no site...
ResponderExcluirFabriciele Arcanjo- 201
O trabalho está ótimo, bem elaborado , um assunto bem interessante.
ResponderExcluirElton Lopes 1 ano 106
- Os trabalhos ficaram muito , me ajudaram a compreender melhor o assunto , e pude tirar algumas dúvidas , só faltou um pouco mais de organização , mas nada grave , parabéns a todos os alunos que se empenharam '
ResponderExcluire parabéns Também a professora Elizania Sousa pela iniciativa de criação do blog, ficou muito bom.
Por: Natália Sousa - 201